
在当今科技飞速发展的时代,人工智能(AI)和自动化技术已经在医药领域扮演了越来越重要的角色。传统的药物研发过程耗时长、成本高,而且往往伴随着不确定性和失败的风险。随着AI的介入,这一过程正发生着翻天覆地的变化。AI不仅可以提高药物发现和设计的效率,还能降低研发成本,加速新药的上市。近日,一项最新研究成果无疑是医药研发领域的一个重要突破。

中国科学院上海药物研究所郑明月团队提出了一种基于序列的药物设计新概念。这一“从序列到药物”(sequence-to-drug)的思路采用端到端的可微学习,直接从蛋白质序列出发进行药物设计发现,而无需经过上述多个中间步骤的复杂流程

日本科学家创建了一个新型数据库专注于环肽的膜渗透性,有望加速基于这些有前途的化合物开发药物的进程。该数据库通过收集数千个环肽的已发表信息并将其整齐地组织一个在线数据库。由于其搜索和可视化功能,该数据库为筛选和设计环肽药物开辟新的计算和机器学习方法铺平道路。

Global Chem 是一个开源图形数据库和 api,用于使用 IUPAC 作为输入和 SMILES/SMARTS 作为输出的常见和稀有化学品列表。Global-Chem是常见小分子及其 SMILES/SMARTS 的化学图网络工具包,可用于辅助药物设计。

伊利诺伊大学芝加哥分校的研究人员开发了一种新型的连续流动微流控装置,它可能帮助科学家和制药公司更有效地研究药物化合物及其结晶形状和结构,这是药物稳定性的关键因素。

瑞典查尔姆斯理工大学的研究人员介绍了一种利用人工智能生成合成蛋白质的方法。这种新方法对于开发高效的工业酶以及抗体和疫苗等新型蛋白质药物有着巨大的潜力。由于瑞典查尔姆斯理工大学的研究人员最近发表的工作,人工智能现在已经能够生成新颖的、具有功能活性蛋白质。
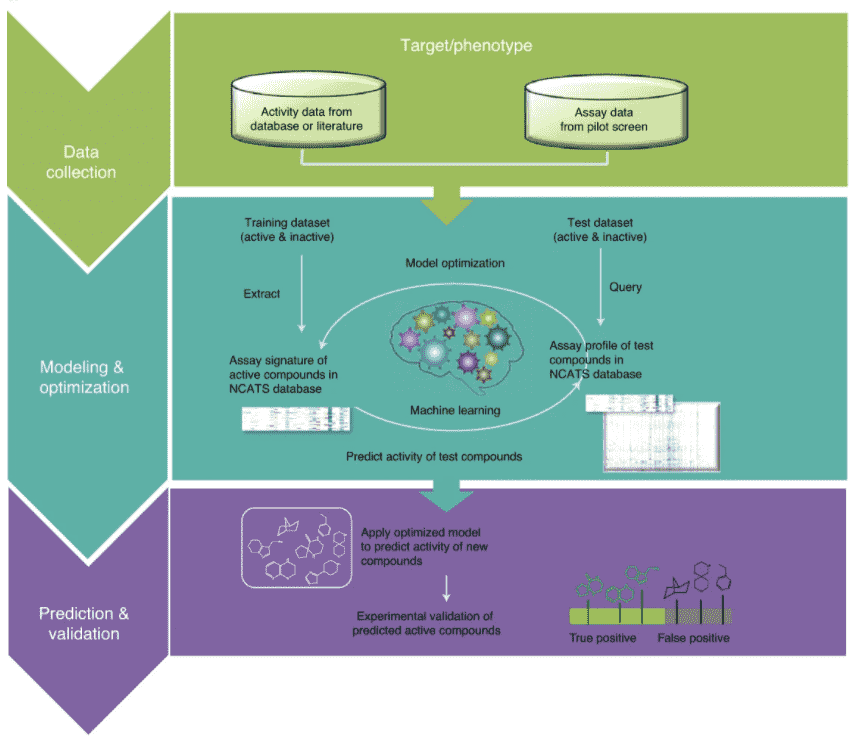
通过活性而不是结构来评估药物化合物是一种新方法,可以加快对COVID-19治疗的搜索速度,并揭示出其他疾病的更多潜在治疗方法。科学家开发基于生物活性的建模可改善有前景的药物筛选,加速药物发现。

近日,香港中文大学(中大)化学系的研究人员,研发出首个用于制备「手性卤代螺环化合物」(chiral halo-spiro compound)的新型催化系统。它是一种极具潜力、可用于不同类型药物的化合物。今次研究将丰富新药设计的化学「工具箱」,制药行业将来有更多原材料可供选择。

根据蛋白质结构预测配体结合位点在阐明蛋白质功能和药物设计方面有许多应用,具体包括药物副作用预测、基于片段的药物发现、对接优先级排序、基于结构的虚拟筛选和基于结构的靶标预测(或称为反向虚拟筛选)等方面。它通常是复杂的计算药物设计工程中的关键步骤。鉴定可与蛋白质结合的配体或小分子也是预测蛋白质功能的重要线索。可以直接在蛋白质的3D结构内确定配体和其他小分子,或者可以使用蛋白质的3D结构预测配体结合位点,从而帮助注释蛋白质。

利用蛋白质结构预测控制蛋白质功能和动力学的内在联系的新技术现已可供科学家使用。该工具由宾夕法尼亚州立大学的研究人员开发,可能对蛋白质工程和药物设计有用。

近日,《科学进展》杂志发表我国学者论文,其上登载了一张“药物击靶”显微镜照片。照片显示:当药物分子(硫黄素T)要与生命体内的靶蛋白结合、起药效时,不是单个分子去结合蛋白,而是自动像乐高积木一样组装后,合力“击靶”,这种“机灵劲儿”与之前人们的想象完全不同。



