世界上首个癌细胞数字模型
多年来,计算机模型一直是基础生物医学研究的标准工具。然而,在1952年霍奇金和赫胥黎首次发表神经细胞的离子电流模型大约70年后,格拉茨理工大学(TU Graz)的研究人员与格拉茨医科大学和纽约纪念斯隆凯特琳癌症中心合作,终于成功地开发出了世界上第一个癌细胞数字模型,因此推出了“现代癌症研究和药物开发的必要工具,”克里斯蒂安·鲍姆加特纳高兴地报道。格拉茨理工大学欧洲医疗设备测试中心医疗保健工程研究所的负责人是发表在《公共科学图书馆计算生物学》杂志上的数字模型的资深作者。该计算机模型是在格拉茨理工大学(TU Graz)研究人员的领导管理下开发的,以人类肺腺癌为例,模拟癌细胞膜电位的周期性变化,为癌症研究开辟了全新的途径。
可兴奋细胞和不可兴奋细胞
到目前为止,数字细胞模型专注于神经或心肌细胞等可兴奋细胞,不仅可以在细胞水平上模拟电生理过程,还可以在组织和器官水平上模拟。这些模型已经被用于支持日常临床实践中的诊断和治疗。由鲍姆加特纳领导的国际研究团队首次专注于非兴奋性癌细胞的特定电生理特性。
在可兴奋的细胞中,电刺激触发了所谓的动作电位。这导致在细胞间传递“电”信息的细胞膜上持续数毫秒的电势短期变化。通过这种机制,神经网络可以相互交流,或者心肌被激活,从而产生收缩。从实验研究中得知,“不可兴奋”的细胞也表现出细胞膜电位的特征波动。然而,与可兴奋的细胞相比,潜在的变化发生得非常缓慢,贯穿整个细胞周期,即数小时或数天,并作为单个细胞周期阶段之间的过渡信号,”Christian Baumgartner解释道。与研究所副所长Theresa Rienmüller和博士生Sonja Langthaler一起,Christian Baumgartner是第一个追求开发这些机制模拟模型的想法的人。
肺腺癌细胞
细胞膜电压的病理变化,特别是在细胞周期中,是癌症发展和进展的基础。Sonja Langthaler继续详细介绍:“离子通道连接细胞的外部和内部。它们能促进钾、钙、钠等离子的交换,从而调节膜电位。离子通道成分的改变以及离子通道功能行为的改变会导致细胞分裂的中断,甚至可能影响细胞分化,从而将健康细胞转化为病变(致癌)细胞。”
对于他们的数字癌细胞模型,研究小组选择了人类肺腺癌细胞系A549作为例子。计算机模型模拟了细胞膜电位在细胞周期阶段之间的转换过程中的节律性振荡,并能够预测由药物诱导的选定离子通道的开关和关闭引起的膜电位的变化。Baumgartner补充说:“所以我们得到了关于定向干预对癌细胞影响的信息。”
“冷冻”癌细胞生长或诱导它们自杀
某些离子通道的活性也可以驱动病变细胞的分裂,从而加速肿瘤的生长。如果离子通道现在被以一种有针对性的方式操纵,就像新的、有前途的药剂和药物那样,可以这么说,细胞膜电压和整个电生理系统都可以脱离轨道。“这可以用于在细胞周期的某个阶段阻止癌细胞,也可以诱导细胞过早死亡(凋亡)。可以在癌细胞生长时“冷冻”癌细胞,或者诱导癌细胞自杀。而正是这种机制可以在模型的帮助下被模拟出来。”鲍姆加特纳和他的团队认为,第一个数字癌细胞模型是更全面研究的开始。为了提高模型的详细程度,已经制定了进一步实验和测量验证的计划,并已提交给奥地利科学基金FWF以获得资助。获取更多前沿科技 研究进展 访问:https://byteclicks.com
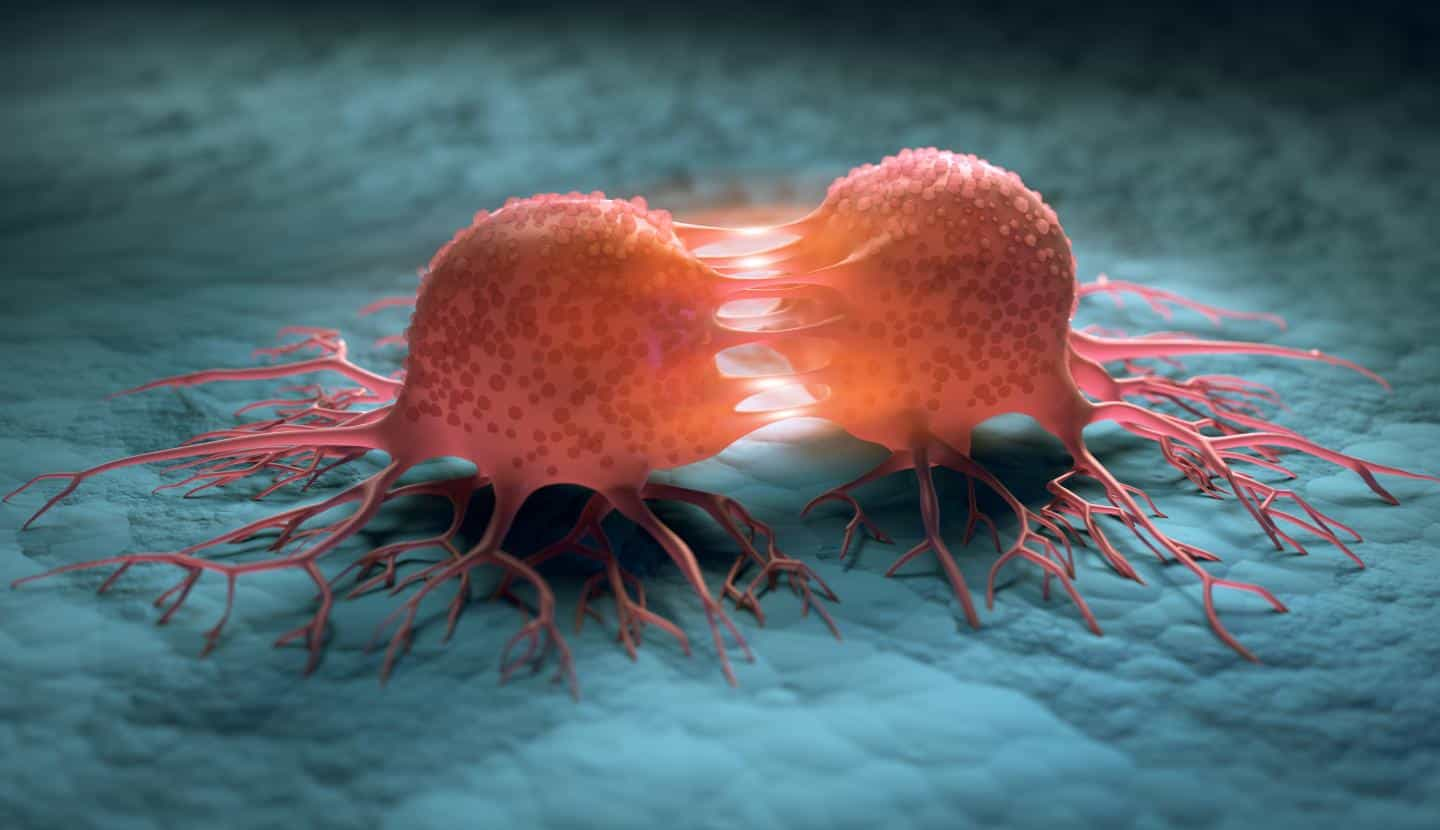
凭借第一个癌细胞模型,TU Graz 的研究人员能够推出现代癌症研究和药物开发的重要工具。图示:分裂癌细胞的图形表示。


